lunes, 11 de junio de 2012
METODOS DE PURIFICACION Y ANALISIS DE LOS CS NUCLEICOS
Una purificación de proteínas es una serie de procesos que permiten aislar un sólo tipo de proteína de una mezcla compleja. La purificación de proteínas es vital para la caracterización de la función, estructura en interacciones de la proteína de interés, por ejemplo una enzima un receptor celular o un anticuerpo. El material inicial es generalmente un tejido biológico o un cultivo microbiano. Hay varios pasos en el proceso de purificación; puede liberar a la proteína de la matriz que lo confina, separar las partes proteica y no proteica de la mezcla, y finalmente separar la proteína deseada de todas las demás. Este último paso puede ser el aspecto más laborioso de la purificación de proteínas.
TÉCNICAS DE BIOLOGÍA MOLECULAR
TÉCNICAS DE BIOLOGÍA MOLECULAR
 En principio se denomina así a todas las técnicas de laboratorio que se usan para aislar ADN o extraerlo en alta pureza, visualizarlo para ver su estado, cortarlo y pegarlo (nacimiento de la Ingeniería genética), amplificar una región en una enorme cantidad de moléculas (clonación de fragmentos en bacterias u otros vectores como virus y PCR), corte de una determinada región con enzimas de restricción para ver si por una mutación se gana o se pierde un sitio de restricción (análisis de mutaciones por RFLP o Restriction fragment lengt polymorphism), que siginifica: diferencias en los tamaños de los fragmentos de restricción debido a polimorfismos en el ADN entre otras.
En principio se denomina así a todas las técnicas de laboratorio que se usan para aislar ADN o extraerlo en alta pureza, visualizarlo para ver su estado, cortarlo y pegarlo (nacimiento de la Ingeniería genética), amplificar una región en una enorme cantidad de moléculas (clonación de fragmentos en bacterias u otros vectores como virus y PCR), corte de una determinada región con enzimas de restricción para ver si por una mutación se gana o se pierde un sitio de restricción (análisis de mutaciones por RFLP o Restriction fragment lengt polymorphism), que siginifica: diferencias en los tamaños de los fragmentos de restricción debido a polimorfismos en el ADN entre otras.
Todas estas técnicas tiene diversas aplicaciones generalmente en el diagnóstico de enfermedades hereditarias, búsqueda de alelos mas o menos frecuentes asociados a una característica que nos interesa seleccionar, diagnóstico de contaminación bacteriana en alimentos (detección de Escherichi coli 0257, cepas difrenctes de Salmonellas, Mycobacterium sp) diagnóstico viral o de infección viral (HIV, Hpatitis C, PIF, otros), selección de marcadores moleculares para asistir en el mejoramiento genético de una especie, test de paternidad, diganóstico de identidad forense, etc.
La primera técnica que todas las demás necesitan es la extracción del ADN, y para ello es necesario purificarlo desde cualquier tejido aunque usualmente se hace a partir de sangre. Se basa en una serie de lavados de la muestra y agregado de proteinasas que eliminan las proteínas del medio, detergentes para elminar las membranas plasmáticas y luego ir purificando el ADN de esa mezcla de ARN proteínas y restos celulares.
Así se ve el ADN recíen extraído en alcohol.
¿Como visualizamos el ADN?
Para poder visualizar el ADN debemos recurrir a los geles de Agarosa. Una vez extraído el ADN o hecha una reacción de PCR debemos verificar que el ADN está allí.
Para eso debemos prepar un gel de agarosa, con una serie de pocillos donde colocar las muestras que sumergidas en el gel y este en un buffer conductor, como el ADN tiene carga negativa migrará hacia el polo positivo si le hacemos pasar una corriente eléctrica.
La Genética molecular aparece desde el descubrimiento de la doble hélice de ADN de Watson y Crick en 1954. Luego Francis Crick continúa con el descubrimiento del código genético en los 60’s. Es decir se descubrió que las bases del ADN se leen de a 3, y tres combinaciones de letras significan un aminoácido que formará parte de una proteína. Allí comienza a comprenderse como es la molécula de ADN y como lleva la información que contiene a la célula que la contiene. A esto se lo denominó “Dogma central de la biología molecular”.
Luego aparece el descubrimiento de las enzimas de restricción que permiten cortar el ADN y así analizarlo. Nace allí la ingeniería genética. Eso permitió cortar y pegar a la molécula de ADN para estudiarla, analizar patologías en ciertos genes, etc. Hasta que, hacia fines de los 80’s, Karl Mullis descubre la técnica de PCR que revolucionó a la genética por su paracticidad y rapidez para amplificar una region de ADN en cantidad suficiente para luego hacer todo tipo de análisis.
Aplicaciones de las técnicas
Son inmumerables las aplicaciones de estas técnicas y quizás las más usadas hoy en dia, son la PCR seguida de una restricción con enzimas y detección de los fragmentos en un gel o seguidas de un gel de poliacrilamida que tiene más definición para la separación de fragmentos de pocas bases de diferencias. Cuando se usa PCR y enzimas de restricción se denominan PCR/RFLP (derivado de variación en la longitud de los fragmentos de restricción en ingles).
Esta técnica puede usarse entre otras cosas para detección de alelos de un gen normales y mutados (enfermedades hereditarias) o para distinguir cepas bacterianas o virales o alelos más favorables para una característica de interés productivo para luego aplicarlo a la selección.
miércoles, 6 de junio de 2012
TAREA UNIDAD 9
LAS BACTERIAS DE DIFERENTES ESPECIES PUEDEN COMPARTIR PLASMIDOS NATURALMENTE ? SI, NO POR QUE ?
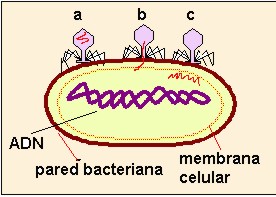
LAS BACTERIAS DE DIFERENTES ESPECIES SI PUEDEN COMPARTIR PLASMIDOS, YA QUE EN ESTE CASO TODAS LAS BACTERIAS TIENEN SU PARED BACTERIANA, ESTA CONSTITUIDA DE LOS MISMOS COMPUESTOS Y AL LLEGAR EL PLASMIDO CREERA QUE ESTAN TRANSFORMANDO UNA BACTERIA DE SU ESPECIE EN ESTE CASO SERIA COMO LOS PERROS DE DIFERENTES RAZAS SI PUEDEN REPRODUCIRSE EN TRE SI PERO TODOS SON PERROS Y TAMBIEN EN ESTE CASO TODAS SERIAN BACTERIAS, OSEA QUE SU MATERIAL GENETICO TIENE CARACTERISTICAS GENERALES PARA TODAS LAS BACTERIAS Y UN MISMO PLASMIDO PODRA TRANSFORMAR DIFERENTES BACTERIAS.
QUIMICOS
El Método del fosfato cálcico:
Uno de los métodos más baratos (y fiables) es la transfección mediante fosfato de calcio, originalmente descubierta por F. L. Graham y A. J. van der Eb en 1973. Una solución salina tamponada con HEPES y que contiene iones fosfato se combina con una solución de cloruro de calcio que contiene el DNA a transfectar. Cuando ambas se combinan, se forma un precipitado fino formado por el calcio cargado positivamente y el fosfato cargado negativamente, que el DNA en su superficie. Esta suspensión se añade a las células que se quieren transfectar (normalmente un cultivo celular en monocapa). Mediante un proceso no comprendido completamente , las células toman parte del precipitado, y junto con él, el DNA.
Método del DEAE dextrano:
Otro método es el uso de polímeros catiónicos (o policationes) como DEAE-dextrano o polietilenimina. El DNA, cargado negativamente, se une al policatión y el complejo es endocitado por la célula.
Método DNA desnudo:
El DNA desnudo (técnica en fase altamente experiemtal) es incapaz de entrar en una célula y aún consiguiendo entrar en ellas es rápidamente degradado.
Método Péptidos fusiogénicos:
Los péptidos fusiogénicos surgen en una linea de trabajo que nos permita paliar aquellas características del DNA desnudo que nos impiden la entrada.
Método de Liposomas:
Otros métodos usan compuestos orgánicos altamente ramificados, los llamados dendrímeros, para unir el DNA e introducirlo en la célula. Un método muy eficiente es la inclusión del DNA en liposomas, pequeños cuerpos formados de una membrana en cierto modo similar a la membrana plasmática de la célula y que puede fusionarse con la misma, liberando el DNA al interior celular. Con células eucariotas, la transfección basada en la interacción lípido-catión es la más comúnmente utilizada, ya que son más sensibles a este método.
biologia.uab.es/genetica/curso/EnsayosAlumnos/.../metoquim.html
ciencia.glosario.net/biotecnologia/adn-desnudo-10034.html
biologia.uab.es/genetica/curso/EnsayosAlumnos/.../metoquim.html
ciencia.glosario.net/biotecnologia/adn-desnudo-10034.html
lunes, 4 de junio de 2012
.MECANISMOS DE TRANSFERENCIA ARTIFICIAL: FISICOS
La microinyección: es un proceso que consiste en utilizar microagujas para insertar sustancias a un nivel microscópico o en el límite de lo macroscópico dentro de una célula viva. Es un simple proceso mecánico en el cual una aguja extremadamente fina penetra la membrana celular y a veces la membrana nuclear para lanzar su contenido. La microinyección es normalmente realizada bajo un microscopio óptico llamado micromanipulador. El proceso es frecuentemente usado como un vector en ingeniería genética y transgenética para insertar material genético en una célula. El proceso de clonación también involucra microinyecciones.
Las microagujas miden alrededor de 10 micrómetros. Pueden contener cerca de 15 microlitros de ADN. Es similar a la sección transversal de un cabello humano. Es un método muy preciso de transferencia génica. Requiere personal capacitado.

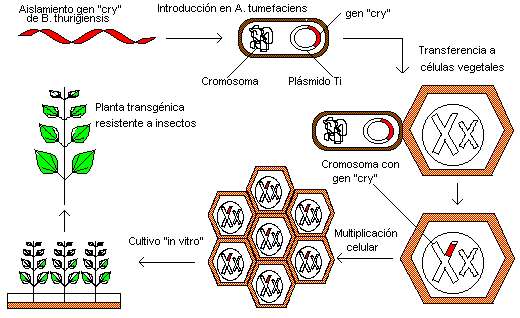
biobalistica: Pequeñas partículas de oro o tungsteno cubiertas de ADN, que se disparan a células vegetales jóvenes o embriones vegetales. Algo del material genético se quedará en las células, transformándolas. Éste método también permite la transformación de plastidos. La eficiencia de transformación es más baja que utilizando Agrobacterium, pero la mayoría de las plantas pueden ser transformadas con este método.

Electroporación: Crea agujeros momentáneos en la membrana celular utilizando golpes eléctricos; esto permite que el ADN entre a la célula, como se ha descrito anteriormente con las bacterias.
TRANSFECCION
La transfección consiste en la introducción de material genético externo en células eucariotas mediante plásmidos, vectores víricos (en este caso también se habla de transducción) u otras herramientas para la transferencia. El término transfección para métodos no virales se usa en referencia a células de mamífero, mientras que el término transformación se prefiere para describir las transferencias no virales de material genético en bacterias y células eucariotas no animales como hongos, algas o plantas.
La transfección de células animales generalmente se lleva a cabo abriendo poros o "agujeros" transitorios en la membrana plasmática de las células mediante electroporación, para permitir el paso del material genético (como construcciones de DNA superenrollado o siRNA) aunque pueden ser transfectadas incluso proteínas (como anticuerpos, por ejemplo). Además de la electroporación, se pueden utilizar otras técnicas para efectuar la transfección, como por ejemplo liposomas producidos mediante la mezcla de lípidos catiónicos con el material genético, que se fusionarán con la membrana plasmática celular y depositarán su carga adentro.
El significado original de "transfección" era "infección por transformación", es decir, introducción de DNA o RNA desde un virus procariótico ó bacteriófago en las células, resultando en una infección. Al tener el término transformación otro sentido en biología celular animal (un cambio genético que permite la propagación durante largos periodos de células en cultivo, o la adquisición de propiedades típicas de las células cancerígenas), el término transfección adquirió, para células animales, su actual signifiado de cambio en las propiedades celulares por la introducción de material genético.

TRANSDUCCION
Los bacteriófagos son virus que parasitan bacterias. Tienen una estructura compleja formada por una cabeza, que contiene el material genético, y una cola que consta de unas fibras con las que se anclan a la superficie bacteriana. El material genético del bacteriófago pasa desde la cabeza, a través de la cola, hasta el interior de la bacteria.
El material genético del virus se integra dentro del material genético bacteriano y se replica. De esta manera el virus se reproduce y forma nuevos bacteriófagos que acaban provocando que la bacteria se destruya y estalle.
CONJUGACION
CONJUGACION
Este proceso se lleva a cabo si la célula presenta el plásmido F, que contiene la información genética para formar pili, puentes que sirven de unión citoplásmica entre dos bacterias. La célula que presenta el plásmido se denomina F+; la célula que no lo contiene se llama F-. La bacteria F+ (donadora de información) se une a una bacteria F- (receptora) mediante uno de sus pili.
A través de él introduce una hebra del plásmido F, de forma que la bacteria F- se convierte en bacteria F+.En ocasiones el plásmido se introduce en el anillo del ADN bacteriano. Entonces, la bacteria donadora se denomina Hfr (High frequency of recombination). De esta forma la bacteria Hfr puede donar a otras células cualquier gen de su ADN.
MECANISMOS DE TRANSFERENCIA NATURAL
TRANSFORMACION
La transformación consiste en la obtención por parte de una célula receptora de un fragmento de DNA y la incorporación de esta molécula al cromosoma de esta célula en una forma heredable. En la transformación natural, el DNA procede de una bacteria donante. Es un proceso al azar, y puede ocurrir entre bacterias de la misma o diferentes especies. Cualquier porción del genoma de la célula donante puede incorporarse, siempre y cuando sea igual o similar a la de la célula huésped. El DNA de la célula donante debe tener las siguientes características: ser de doble hélice, similar al DNA de la célula receptora, de bajo peso molecular y de tamaño pequeño.
.

Fragmentos de ADN que pertenecían a células lisadas (rotas)se introducen en células normales. El ADN fragmentado recombina con el ADN de la célula receptora, provocando cambios en la información genética de ésta.
En biología molecular, transformación es la altertérminos para las alteraciones genéticas resultantes de introducir ADN por virus (transducción) o por contactos intercelulares entre bacterias (conjugación). A la transformación de células animales se le llama transfección.
El término transformación es también usado, de manera más general, para describir mecanismos de transferencia de ADN o ARN en biología molecular (es decir, teniendo en cuenta más que las consecuencias genéticas). Por ejemplo la producción de transgénicos como maíz transgénico requiere la inserción de nueva información genética en el genoma del maíz usando el mecanismo apropiado de transferencia de ADN; el proceso se le llama comúnmente transformación.
El ARN también puede ser transferido en las células usando métodos similares, pero esto no provoca normalmente cambios heredables y por lo tanto no es información real.

INTRODUCCION
El mecanismo de reproducción habitual en bacterias es la bipartición. Mediante este mecanismo se obtienen dos células hijas, con idéntica información en el ADN circular, entre sí y respecto a la célula madre, y de contenido citoplásmico celular similar. Las células hijas son clones de la progenitora. Por este sistema de reproducción se puede originar una colonia de células con material idéntico; sin embargo, esto no ocurre debido al alto índice de mutaciones que se producen en las bacterias.
En ocasiones, la célula bacteriana tiene la oportunidad de intercambiar información genética por procesos de recombinación. Estos procesos son la transformación, la transducción y la conjugación. En estos procesos no hay formación de ningún tipo de gametos, por lo que no es reproducción sexual.
La bipartición se produce cuando la célula ha aumentado su tamaño y ha duplicado su ADN. El ADN bacteriano se une a un mesosoma, que separa el citoplasma en dos y reparte cada copia del ADN duplicado a cada lado. Al final del proceso el mesosoma se ha unido al resto de la membrana plasmática y se han formado dos células hijas genéticamente iguales.
objetivos
Conocer cuales son los mecanismmos de transferencia natural y los mecanismos de transferencia artificial y dar a conocer en que consiste cada uno de estos y las funciones que presentan cada uno.
portada
INSTITUTO TECNOLOGICO DE CD ALTAMIRANO
BIOLOGIA MOLECULAR
UNIDAD 9
TRANSFERENCIA DEL MATERIAL GENETICO
ALUMNA:
RUBI PEREZ CARRANZA
PROFESOR:
FRANCISCO JAVIER PUCHE ACOSTA
TAREA DE LA UNIDAD N° 8
COMO SE REALIZA EL CONTROL GENICO DEL GEN BRCA?
BRCA1
 Las mutaciones más frecuentes en el gen BRCA1 corresponden a delecciones o inserciones de bases que provocan un desplazamiento de la fase de lectura, Son las llamadas mutaciones frameshift, que aparecen hasta en el 71% de los casos. Existen mutaciones puntuales consistentes en la sustitución de un solo nucleótido, se denomina mutación missense. Si el nucleótido que es sustituido provoca un codón stop, finalizando la traducción de la proteína, se conoce como mutación nonsense. Es posible que la frameshift sea la mutación más frecuente, al ser la que se detecta con más facilidad.
Las mutaciones más frecuentes en el gen BRCA1 corresponden a delecciones o inserciones de bases que provocan un desplazamiento de la fase de lectura, Son las llamadas mutaciones frameshift, que aparecen hasta en el 71% de los casos. Existen mutaciones puntuales consistentes en la sustitución de un solo nucleótido, se denomina mutación missense. Si el nucleótido que es sustituido provoca un codón stop, finalizando la traducción de la proteína, se conoce como mutación nonsense. Es posible que la frameshift sea la mutación más frecuente, al ser la que se detecta con más facilidad.
Se han encontrado algunos rasgos que aumentan la probabilidad de poseer mutaciones de BRCA1: la existencia de cáncer de mama y ovario en un mismo individuo de la familia, el diagnóstico de cáncer de mama a una edad joven, y la existencia entre los ancestros de judíos Asquenazíes. Las portadoras de esta mutación presentan un aumento del riesgo de padecer cáncer de mama a una edad temprana de 27 veces, con un riesgo atribuido del 20%.[6] Estas observaciones serán de gran utilidad en la práctica clínica para elegir aquellas mujeres de mayor riesgo para realizar los estudios genéticos en busca de las mutaciones del gen BRCA1.
Desde la localización y posterior clonación del gen BRCA1 se han podido realizar estudios que distinguen con más precisión los casos de cáncer hereditario de los esporádicos, para poder luego determinar las posibles diferencias clínicas y patológicas entre ambos. El conocimiento de estas características tendría importantes implicaciones en la vigilancia, diagnóstico y tratamiento del cáncer de mama en las portadoras de mutaciones del BRCA1.
El gen BRCA 2
Con respecto a las mutaciones del BRCA2 se asocian con el subtipo luminal y son de alto grado histológico. Son de buen pronóstico. Su tratamiento estándar es la terapia hormonal y no se sabe si se benefician con tratamiento quimioterápico adicional.
En 1994 se localizó este gen relacionado con la susceptibilidad heredada al cáncer de mama, ligado al cromosoma 13. Este gen podría ser el responsable del 25-30% de los casos de cáncer de mama.
La mujer portadora de la mutación BRCA2 tendría un riesgo perpetuo de cáncer de mama de aproximadamente 85%, y su riesgo para cáncer ovárico está en el rango de 10-20%.
El varón portador de la mutación BRCA2 tienen un 7% riesgo perpetuo aproximado para cáncer de mama.[8]
Estudios genéticos
Estos estudios tienen limitaciones. No todas las portadoras de estas mutaciones desarrollarán cáncer de mama u ovario y no toda mutación detectada tiene importancia clínica.
Las mujeres con mutaciones del BRCA1 y BRCA 2 tienen a lo largo de su vida un riesgo del 80% para desarrollar cáncer de mama y un 20 a 80% cáncer de ovario
BRCA 1 Y 2
Bibliografía P. Zamora Auñón, E. Espinosa Arranz y M. González Barón Servicio de Oncología Médica. Hospital La Paz. Madrid. Medicine 2001; 8(57): 30413049
[2] U.S. Preventive Services Task Force. Genetic risk assessment and BRCA mutation testing for breast and ovarian cancer susceptibility. Ann Intern Med. 2005;143:355-61.
[3] Ford D, Easton DF, Stratton M, et al. Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in breast cancer families. The Breast Cancer Linkage C o n s o rtium. Am J Hum Genet 1998;62:676-689
Suscribirse a:
Comentarios (Atom)