EN ESTA UNIDAD OBSERVAMOS COMO SE DA EL PROCESO DE LA SÍNTESIS DE PROTEÍNAS Y COMO ES CONTROLADA POR LOS DIFERENTES FACTORES, COMO LO ES EL OPERON DE LACTOSA Y EL OPERON TRIPTOFANO. ADEMAS DE LAS DIFERENCIAS QUE PRESENTA ESTE PROCESO TANTO EN ORGANISMOS EUCARIOTICOS COMO PROCARIOTICOS.
martes, 29 de mayo de 2012
REGULACIÓN DE LA TRANSCRIPCIÓN EN ORGANISMOS EUCARIOTICOS
En las células eucariotas, la capacidad de expresar proteínas biológicamente activas resulta de diferentes niveles regulatorios.

La compactación de la cromatina afecta la capacidad de unión de las enzimas y factores transcripcionales de genes específicos. La cromatina se puede dividir en dos clases según su patrón de tinción. La eucromatina se tiñe suavemente y se corresponde con regiones del genoma que están disponibles para la transcripción. Por otro lado, la heterocromatina, se tiñe intensamente y se corresponde a regiones del genoma que están densamente compactadas e inaccesibles para el aparato transcripcional.
Se pueden distinguir dos clases de heterocromatina: la constitutiva y la facultativa. La constitutiva hace referencia a cromosomas o parte de ellos que son heterocromáticos en todas las células de una misma especie, mientras que la facultativa implica zonas de cromosomas que se pueden descompactar tornándose en eucromatina en algunas células de un mismo organismo.
Como la heterocromatina no puede ser transcripta, la expresión génica en los eucariontes se puede reprimir por condensación de eucromatina en heterocromatina. Todavía no se conocen todos los factores que modulan la descompactación de la cromatina. Ciertamente hay proteínas que reconocen secuencias específicas del DNA y una vez unidas, transmiten la señal de descondensación de cerca de 10000 pares de bases correspondientes a un bucle de la cromatina.
Las acetilaciones y desacetilaciones de histonas son modificaciones covalentes frecuentes en estos fenómenos de descompactación cromatínica. Un ejemplo típico de este tipo de regulación ocurre en la acetilación de coactivadores involucrados en las transcripciones genéticas moduladas por las hormonas tiroideas. Las acetilaciones se producen en los residuos de lisina de los extremos aminoterminales de las histonas, reduciendo su carga positiva y por lo tanto su afinidad de unión al ADN cargado negativamente. La desacetilación de las histonas, mediada por desacetilasas provoca el efecto contrario (recompactación).
Secuencias características de organización del DNA como los palíndromes así como la disposición espacial del DNA Z han sido relacionados con señalizaciones para el sitio de inicio de la transcripción.
Modificaciones covalentes del ADN
Metilaciones de residuos de desoxicitidina:
La metilación de los restos de citosina en el ADN, especialmente en los sitios promotores, dificultan la transcripción. Por ejemplo: los genes de globina están más metilados en células no productoras de hemoglobina que en los eritroblastos. Las metilaciones se producen en secuencias específicamente reconocidas ( 5’--- m CpG ---3’) que generalmente se agrupan en “islotes” ricos en GC, con frecuencia dentro o cerca de regiones reguladoras de la transcripción.
La metilación puede inhibir la transcripción de los genes al interferir en la capacidad de los factores de transcripción para reconocer los sitios de unión al ADN o alterando las conformaciones del ADN dificultando la polimerización de la ARN polimerasa. Uno de los ejemplos más espectaculares de la metilación ocurre durante el fenómeno de impresión genómica. Así, el conjunto de cromosomas heredados del progenitor masculino no es funcionalmente equivalente al conjunto de cromosomas heredados de la madre.Existen por lo menos 100 genes sometidos a esta expresión diferencial. Las versiones activas e inactivas de los genes difieren en sus patrones de metilación. Las diferencias en los alelos se originan durante la gametogénesis.
Modificación del número y de la estructura de los genes:
La eliminación total o parcial de genes impide la formación de ARNm y de la proteína correspondiente, los glóbulos rojos son un caso extremo donde una vez sintetizadas las proteínas estructurales y funcionales, la eliminación del núcleo en la etapa de eritroblasto ortocromático produce una célula incapaz de sintetizar toda otra proteína de novo presentando un 90% del contenido proteico total como hemoglobina.
Otro caso es la recombinación somática de la línea germinal de los linfocitos B. En este tipo particular de regulación de la expresión de genética, los genes codificantes de las cadenas pesadas y livianas de la inmunoglobulinas sufren un rearreglo independiente de la presencia del antígeno. Allí, se produce el corte y empalme al azar de diversos fragmentos génicos de manera irreversible que dan origen al variado repertorio de las inmunoglobulinas.
Por otra parte, la presencia de genes en tandem, implica la presencia de de múltiples copias de un gen que aumentan la capacidad de producción de la proteína requerida en grandes cantidades. Es el caso de los genes codificantes de histonas y ARN 5S.
La regulación génica se puede regular también en función de la disponibilidad del DNA incrementando el número de copias de un gen accesible. Este mecanismo de regulación se conoce como amplificación génica. Una forma de amplificación es la repetición sucesiva de la replicación de una secuencia específica del ADN. Este fenómeno se observó en la amplificación de ciertos genes cuyos productos son necesarios para el desarrollo de algunos insectos y anfibios. Como ejemplo puede citarse el ARN ribosómico en la rana Xenopus laevis, donde los gnes que codifican los ARN r 5.8 S, 18S y 28 S se amplifican de 500 a 2 millones de copias.
CONTROL TRANSCRIPCIONAL DE LA EXPRESION GENETICA
Constituye uno de los modos más importantes de regulación de la expresión proteica en eucariontes. En esta categoría están incluídos los promotores, la presencia de secuencias regulatorias potenciadoras (enhancers), y la interacción entre múltiples proteínas activadoras o inhibidoras que actúan mediante su unión a secuencias específicas de reconocimiento al ADN.Las regulaciones pueden ser de tipo CIS o TRANS.
Cuando el elemento regulador transcripcional es parte de la cadena polinucleotídica donde se localiza el gen a regular, se denomina regulador CIS. Evidentemente se tratan de secuencias especiales del ADN (promotores y enhancers).
Cuando los elementos regulatorios son de naturaleza y origen diferente a la secuencia genética a controlar, la regulación es de tipo TRANS (aquí se incluyen a los factores de transcripción generales, histoespecíficos y todas las proteínas regulatorias con capacidad de unión al ADN).

lunes, 28 de mayo de 2012
OPERON TRIPTOFANO
 El Operón Triptófano regula la transcripción de las enzimas que intervienen en una vía anabólica. Las cinco enzimas que regula este Operón pertenecen a la vía anabólica del aminoácido Triptófano. Es más que innecesaria la síntesis de un aminoácido, por parte de la célula, cuando la misma contiene cantidades suficientes de él. Cuando la concentración de Triptófano es la adecuada el represor inactivo, codificado por el gen regulador, se une a otra molécula que le confiere la capacidad para acoplarse al operador.
El Operón Triptófano regula la transcripción de las enzimas que intervienen en una vía anabólica. Las cinco enzimas que regula este Operón pertenecen a la vía anabólica del aminoácido Triptófano. Es más que innecesaria la síntesis de un aminoácido, por parte de la célula, cuando la misma contiene cantidades suficientes de él. Cuando la concentración de Triptófano es la adecuada el represor inactivo, codificado por el gen regulador, se une a otra molécula que le confiere la capacidad para acoplarse al operador.
Al estar el operador ocupado, la ARN polimerasa no podrá formar el Complejo Promotor Abierto, por lo tanto, la síntesis de las enzimas intervinientes en la vía anabólica del Triptófano no son producidas. El co-represor, molécula que confiere la activación del represor, es nada más ni nada menos que el Triptófano.
Es sumamente lógico que lo sea, ya que cuando hay una alta concentración de Triptófano, no es necesario gastar energía en sintetizarlo. Si la concentración de mencionado aminoácido es baja, el represor no podrá unirse al co-represor, por tal motivo el represor no adquirirá la capacidad de unirse al operador.
Al encontrarse el operador libre, la ARN polimerasa podrá iniciar la transcripción de los genes estructurales, obteniéndose las enzimas necesarias para poder sintetizar este aminoácido esencial.
OPERON LACTOSA
El Operón lactosa, que abreviadamente se denomina Operón lac, es un sistema inducible que está bajo control negativo, de manera que la proteína reguladora, producto del gen regulador i, es un represor que impide la expresión de los genes estructurales en ausencia del inductor. El inductor del sistema es la lactosa. Como veremos más adelante, el operón lac también está bajo control positivo, ya que existe otra proteína que estimula la transcripción de los genes estructurales.
Los genes estructurales del operón lactosa son los siguientes:
- El gen z+: codifica para la b-galactosidasa que cataliza la hidrolisis de la lactosa en glucosa más galactosa.
- El gen y+: codifica para la galactósido permeasa que transporta b-galactósidos al interior de la célula bacteriana.
- El gen a+: codifica para la tiogalactósido transacetilasa que cataliza la transferencia del grupo acetil del acetil Coenzima A al 6-OH de un aceptor tiogalatósido. Este gen no está relacionado con el metabolismo de la lactosa.
El verdadero inductor del sistema es la Alolactosa y no la lactosa de manera que la β-galactosidasa transforma la lactosa en Alolactosa. En los estudios del operón lactosa se utiliza como inductor un análogo sintético de la lactosa que es el Isopropil tiogalactósido (IPTG). El IPTG no necesita ser transportado por la galactósido permeasa para entrar en la bacteria.
Las cepas normales de E. coli son inducibles, de manera que en ausencia del inductor (la lactosa), la proteína represora producto del gen i se encuentra unida a la región operadora e impide la unión de la ARN-polimerasa a la región promotora y, como consecuencia, no se transcriben los genes estructurales.



En presencia del inductor (la lactosa), este se une a la proteína reguladora que cambia su conformación y se suelta de la región operadora dejando acceso libre a la ARN-polimerasa para que se una a la región promotora y se transcriban los genes estructurales. Por consiguiente, la presencia del inductor hace que se expresen los genes estructurales del operón, necesarios para metabolizar la lactosa.
Es conveniente recordar que los tres genes estructurales del operón lactosa se transcriben juntos en un mismo ARNm, es decir que los ARN mensajeros de bacterias suelen ser policistrónicos, poligénicos o multigénicos. Sin embargo, en eucariontes los mensajeros suelen sen monocistrónicos o monogénicos, es decir, corresponden a la transcripción de un solo gen estructural.

En la siguiente tabla se muestra la expresión de los genes del operón lactosa en ausencia y en presencia del inductor (lactosa) en una bacteria normal i+ p o z+y+a+. SI = significa que se expresan, NO = significa que no se expresan.
Bacteria normal
|
Expresión de los genes estructurales del Operón lactosa
| |||||
| Ausencia de inductor (Sin lactosa) | Presencia de inductor (Con lactosa) | |||||
| Genotipo | z+ | y+ | a+ | z+ | y+ | a+ |
| i+ p o z+y+a+ | NO | NO | NO | SI | SI | SI |
El conocimiento profundo del funcionamiento del operón lactosa se obtuvo gracias a la obtención de mutantes que afectaban a los genes estructurales, a los elementos de control (promotor y operador) y al gen regulador. Además, también fue muy importante el estudio del operón lactosa en bacterias diploides parciales o merocigotos.
REGULACION DE LA TRANSCRIPCION EN ORGANISMOS PROCARIOTICOS

En las bacterias, a pesar de ser organismos unicelulares, también es necesario regular la expresión de los genes adaptándola a las necesidades ambientales. Es un principio de economía celular el que la expresión de los genes este regulada según las circunstancias celulares. Un buen ejemplo de esta situación en bacterias es la regulación de las enzimas implicadas en el metabolismo de los azúcares. Las bacterias pueden emplear para obtener energía distintas fuentes de carbono, como la glucosa, lactosa, galactosa, maltosa, ramnosa y xilosa. Existen enzimas capaces de introducir cada uno de estos azúcares en la bacteria y enzimas capaces de romperlos para obtener energía. Lógicamente, sería un despilfarro energético producir simultáneamente todos los enzimas necesarios para metabolizar los diferentes azúcares mencionados. Por consiguiente, sería mucho más económico para la célula producir solamente las enzimas necesarias en cada momento, es decir, si en el medio en el que vive la bacteria la principal fuente de carbono es la lactosa, solamente se expresarían los genes necesarios para metabolizar la lactosa, mientras que los otros genes no se expresarían. Por tanto, es esencial que exista un mecanismo de regulación de la expresión génica, de manera que los genes se expresen cuando sea necesario.
La regulación de la producción de proteínas (síntesis de proteínas) considerando el proceso en su conjunto, puede llevarse a cabo en tres niveles:
- Replicación
- Transcripción
- Traducción.
De los tres niveles de regulación, uno de los mejor conocidos actualmente es la regulación durante la transcripción. Aunque la regulación de la transcripción en eucariontes es más compleja que en bacterias, muchos de sus aspectos son similares. Por tanto, comenzaremos por el estudio de la regulación de la transcripción en bacterias.
NIVELES DE REGULACION DE LA EXPRESION GENETICA

La regulación genética comprende todos aquellos procesos que afectan la acción de un gen a nivel de traducción o transcripción, regulando sus productos funcionales.
1) CONFORMACION Y ESTRUCTURA DEL ADN
Compactación diferencial de la cromatina
La compactación de la cromatina afecta la capacidad de unión de las enzimas y factores transcripcionales de genes específicos. La cromatina se puede dividir en dos clases según su patrón de tinción. La eucromatina se tiñe suavemente y se corresponde con regiones del genoma que están disponibles para la transcripción. Por otro lado, la heterocromatina, se tiñe intensamente y se corresponde a regiones del genoma que están densamente compactadas e inaccesibles para el aparato transcripcional.
Se pueden distinguir dos clases de heterocromatina: la constitutiva y la facultativa. La constitutiva hace referencia a cromosomas o parte de ellos que son heterocromáticos en todas las células de una misma especie, mientras que la facultativa implica zonas de cromosomas que se pueden descompactar tornándose en eucromatina en algunas células de un mismo organismo.
Como la heterocromatina no puede ser transcripta, la expresión génica en los eucariontes se puede reprimir por condensación de eucromatina en heterocromatina. Todavía no se conocen todos los factores que modulan la descompactación de la cromatina. Ciertamente hay proteínas que reconocen secuencias específicas del DNA y una vez unidas, transmiten la señal de descondensación de cerca de 10000 pares de bases correspondientes a un bucle de la cromatina.
Las acetilaciones y desacetilaciones de histonas son modificaciones covalentes frecuentes en estos fenómenos de descompactación cromatínica. Un ejemplo típico de este tipo de regulación ocurre en la acetilación de coactivadores involucrados en las transcripciones genéticas moduladas por las hormonas tiroideas. Las acetilaciones se producen en los residuos de lisina de los extremos aminoterminales de las histonas, reduciendo su carga positiva y por lo tanto su afinidad de unión al ADN cargado negativamente. La desacetilación de las histonas, mediada por desacetilasas provoca el efecto contrario (recompactación).
Secuencias características de organización del DNA como los palíndromes así como la disposición espacial del DNA Z han sido relacionados con señalizaciones para el sitio de inicio de la transcripción.
2) CONTROL TRANSCRIPCIONAL DE LA EXPRESION GENETICA
Constituye uno de los modos más importantes de regulación de la expresión proteica en eucariontes. En esta categoría están incluídos los promotores, la presencia de secuencias regulatorias potenciadoras (enhancers), y la interacción entre múltiples proteínas activadoras o inhibidoras que actúan mediante su unión a secuencias específicas de reconocimiento al ADN.
Las regulaciones pueden ser de tipo CIS o TRANS.
Cuando el elemento regulador transcripcional es parte de la cadena polinucleotídica donde se localiza el gen a regular, se denomina regulador CIS. Evidentemente se tratan de secuencias especiales del ADN (promotores y enhancers).
Cuando los elementos regulatorios son de naturaleza y origen diferente a la secuencia genética a controlar, la regulación es de tipo TRANS (aquí se incluyen a los factores de transcripción generales, histoespecíficos y todas las proteínas regulatorias con capacidad de unión al ADN).
3)- CONTROL POST-TRANSCRIPCIONAL DE LA EXPRESION GENETICA
Aunque el inicio de la transcripción es el sitio primario de la regulación de la expresión de genes, la síntesis del transcripto primario no es el único momento en que las células controlan la producción adecuada de proteínas.
http://med.unne.edu.ar/catedras/bioquimica/expresion.htm
http://med.unne.edu.ar/catedras/bioquimica/expresion.htm
INTRODUCCION
Los organismos multicelulares complejos están compuestos de diferentes tejidos cuyas características individuales dependen de las proteínas específicas expresadas por sus tipos celulares. La diferenciación, el desarrollo y la funcionalidad de los tejidos específicos dependen del conjunto de proteínas selectivamente expresadas por cada célula. Estas proteínas expresadas en forma diferencial pueden funcionar como componentes estructurales de las células, enzimas reguladoras del metabolismo, factores de transcripción, receptores celulares, componentes intracelulares de señalización, etc.
La expresión incorrecta de tales proteínas, su expresión en lugares equivocados, a destiempo, o la producción en cantidades anormales de proteínas específicas o de proteínas de función anómala subyace a toda patología celular de base genética.
Por consiguiente el conocimiento de los mecanismos de regulación de la expresión proteica en eucariontes contribuirá al conocimiento de las bases moleculares de diversas patologías.
En las células eucariotas, la capacidad de expresar proteínas biológicamente activas resulta de diferentes niveles regulatorios
http://med.unne.edu.ar/catedras/bioquimica/expresion.htm
OBJETIVOS
Integrar los conocimientos anteriores con los mecanismos de regulación genética para entender a nivel molecular los procesos metabólicos.
miércoles, 23 de mayo de 2012
TAREA
EXPLIQUE:
Es posible que la maquinaria eucarionte
de traducción (ribosomas, factores, enzimas, RNAt) puedan traducir
el RNAm de una bacteria? explique identificando
los inconvenientes que encontrarías.
REPUESTA:
Si se podrá
llevar a cabo el proceso en la maquinaria eucarionte
de traducción traduciendo el ARNm de una bacteria, pero con algunos errores
porque el ribosoma eucariota es más grande que el procariota además de otras
diferencias, así que también el ARNm de los procariotas debe ser más sencillo y
no cubriría las funciones del ribosomas en su totalidad y resultaran sobrantes
enzimas y factores de traducción así que el proceso si puede llevarse a cabo
pero se van a traducir fragmentos de ARNm incorrectamente ya que algunas
enzimas y factores no tendrán una función especifica en este proceso.
miércoles, 16 de mayo de 2012
MODIFICASIONES POSTRADUCCIONALES
1.-Transformaciones para que la proteína sea nativa. Las diferencias entre la proteína sintetizada y la nativa son:
- Puede perder aminoácidos por ruptura del enlace peptídico. Es común la pérdida del N-terminal (Met).
- Modificaciones químicas de las cadenas laterales de los aminoácidos codificados. Pueden ser durante la síntesis (contraduccionales) o después (post-traduccionales). Siempre tras la incorporación del aminoácido a la cadena. A veces implica reaccionar con hidratos de carbono, metilación, hidroxilación ...
2.- Es esencial que la cadena polipeptídica se pliegue (estructuras secundaria y terciaria). El plegamiento ocurre cuando la proteína se sintetiza, no espera a que esté la cadena completa, porque los grupos hidrofóbicos molestarían. Puede ser que los primeros plegamientos no sean los óptimos, por lo que ayudan carabinas moleculares protegiendo las regiones hidrofóbicas, para lo que se unen reversiblemente.
3.- Para que sean funcionales deben localizarse dentro de la célula. En los eucariotas hay muchas membranas que deben ser traspasadas. En eucariotas hay síntesis de proteínas:
- Dentro de mitocondrias y cloroplastos, que sintetizan para ellos mismos con ribosomas propios aunque necesiten proteínas del exterior.
- A partir del DNA nuclear se sintetizan proteínas por los ribosomas en el citosol.
Las proteínas sintetizadas en el citosol pueden tener varios destinos:
- Para distinguir entre varios destinos tendrán que tener una señal de localización.
- En el orgánulo habrá un receptor que reconozca esa señal.
Una célula no se puede obtener a partir del DNA. hace falta más información, epigenética, que diga qué cosa ha de ir dónde. Las proteínas que se han de quedar en el citosol no tienen señal porque siempre hay un sitio por defecto.
Transportar una proteína a través de una membrana se puede hacer de dos maneras:
- Si ha de pasar a través de la membrana no podrá haberse plegado. Si la proteína es globular no podrá pasar porque la membrana es hidrofóbica, por lo que tendrá que estar parcialmente desplegada y protegida por carabinas.
- Se puede englobar las proteínas dentro de una vesícula que se fusione con la membrana y las libere dentro. Las proteínas deben estar dentro del retículo y pueden estar plegadas.
- El núcleo tiene poros por los que pueden pasar las proteínas ya plegadas.
Hay dos tipos de transporte:
- Post-traduccional: las proteínas primero se sintetizan y luego se transportan.
- Cotraduccional: siempre van al retículo endoplásmico. El retículo rugoso tiene ribosomas que sintetizan proteínas que se quedan dentro (tienen una señal que hace que se peguen al retículo). Luego se suelta el ribosoma. Las proteínas de las membranas entran siempre dentro del retículo. Como tienen muchos trozos hidrofóbicos al sintetizarse se incorporan a la membrana y ya no salen de ella. Viajan en vesículas.
ETAPAS DE SINTESIS DE PROTEINAS EN ORG. EUCARIOTICOS
EUCARIOTAS
Es más complicada por:
- Muchos más factores de iniciación.
- No hay secuencias de Shine-Dalgarno,
- la colocación es por otros procedimientos,
- El ARNt no tiene una zona complementaria.

esquema de inicio de traducción de ARNt
TERMINACION
ETAPAS DE SINTESIS DE PROTEINAS EN ORG. PROCARIOTICOS
Tres etapas en la síntesis de proteínas en procariotas

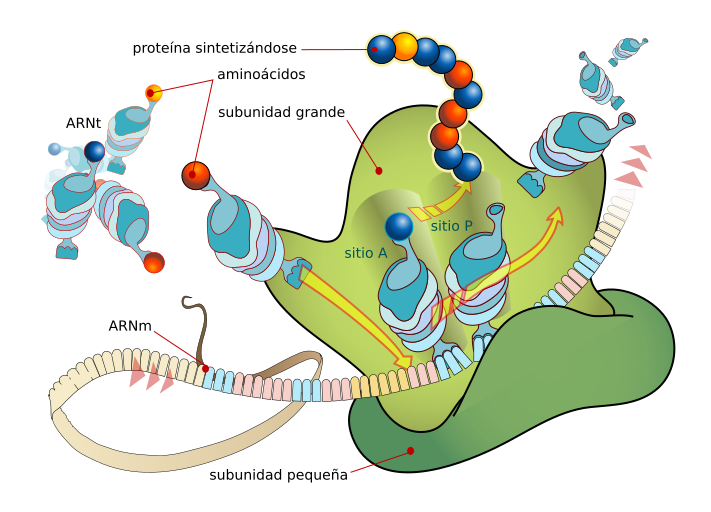
a síntesis de proteínas ocurre en varias etapas: a) Iniciación. La subunidad ribosómica más pequeña se une al extremo 5' de una molécula de mRNA. La primera molécula de tRNA, que lleva el aminoácido modificado fMet, se acopla con el codón iniciador AUG de la molécula de mRNA. La subunidad ribosómica más grande se ubica en su lugar, el complejo tRNA-fMet ocupa el sitio P (peptídico). El sitio A (aminoacil) está vacante. El complejo de iniciación está completo ahora.
 Un segundo tRNA, con su aminoácido unido, se coloca en el sitio A y su anticodón se acopla con el mRNA. Se forma un enlace peptídico entre los dos aminoácidos reunidos en el ribosoma. Al mismo tiempo, se rompe el enlace entre el primer aminoácido y su tRNA. El ribosoma se mueve a lo largo de la cadena de mRNA en una dirección 5' a 3', y el segundo tRNA, con el dipéptido unido, se mueve desde el sitio A al sitio P, a medida que el primer tRNA se desprende del ribosoma. Un tercer aminoacil-tRNA se coloca en el sitio A y se forma otro enlace peptídico. La cadena peptídica naciente siempre está unida al tRNA que se está moviendo del sitio A al sitio P y el tRNA entrante que lleva el siguiente aminoácido siempre ocupa el sitio A. Este paso se repite una y otra vez hasta que se completa el polipéptido.
Un segundo tRNA, con su aminoácido unido, se coloca en el sitio A y su anticodón se acopla con el mRNA. Se forma un enlace peptídico entre los dos aminoácidos reunidos en el ribosoma. Al mismo tiempo, se rompe el enlace entre el primer aminoácido y su tRNA. El ribosoma se mueve a lo largo de la cadena de mRNA en una dirección 5' a 3', y el segundo tRNA, con el dipéptido unido, se mueve desde el sitio A al sitio P, a medida que el primer tRNA se desprende del ribosoma. Un tercer aminoacil-tRNA se coloca en el sitio A y se forma otro enlace peptídico. La cadena peptídica naciente siempre está unida al tRNA que se está moviendo del sitio A al sitio P y el tRNA entrante que lleva el siguiente aminoácido siempre ocupa el sitio A. Este paso se repite una y otra vez hasta que se completa el polipéptido. Cuando el ribosoma alcanza un codón de terminación (en este ejemplo UGA), el polipéptido se escinde del último tRNA y el tRNA se desprende del sitio P. El sitio A es ocupado por un factor de liberación que produce la disociación de las dos subunidades del ribosoma.
Cuando el ribosoma alcanza un codón de terminación (en este ejemplo UGA), el polipéptido se escinde del último tRNA y el tRNA se desprende del sitio P. El sitio A es ocupado por un factor de liberación que produce la disociación de las dos subunidades del ribosoma.
Resumen general de la síntesis de proteínas en una bacteria
A partir del DNA cromosómico se transcriben: diferentes moléculas de rRNA que, combinadas con proteínas específicas, forman los ribosomas; los diferentes tipos de moléculas de tRNA correspondientes a los distintos aminoácidos y los mRNA, que llevan la información para la secuencia de aminoácidos de las proteínas. Cuando un mRNA se une a la subunidad menor del ribosoma, comienza el proceso de síntesis de proteínas, que se describe en detalle en el texto.
ESTRUCTURA RIBOSOMAL: PROCARIOTICO Y EUCARIOTICO
PROCARIOTICO

En bacterias, la subunidad 50S es aproximadamente dos veces la masa de la subunidad 30S, y en ambas, aproximadamente 2/3 de su peso se debe al ARNr mientras que el resto del peso es atribuible a la parte proteica del ribosoma.
La subunidad 30S tiene una forma mas o menos trapezoidal cuando se tiene una vista frontal desde la zona de interaccion de subunidades (
La subunidad 50S tiene una forma aproximadamente hemisferica enfrentada a la subunidad 30S por su lado liso. Desde la region de interaccion entre subunidades se distinguen 3 protuberancias: el tallo L7/L12 que se extiende a lo largo de su base, la protuberancia central y el tallo L1. El tallo L7/L12, formado por las proteinas dimericas L7/L12, a veces puede estar
ausente en mapas de microscopia electronica debido a su elevada flexibilidad.
La protuberanciacentral esta formada, en su mayor parte, por el ARNr 5S. Al contrario que el tallo L7/L12, el tallo L1 esta siempre bien definido, formado por la proteina ribosomal L1 y parte del ARNr. Figura 1.3): el espacio entre subunidades, por donde iran circulando los ARNt durante la traduccion. El ensamblaje se mantiene mediante diversos puentes que se crean entre subunidades. Existe un total de 12 puentes entre subunidades creados por mas de 30 interacciones individuales y la mayoria de ellos involucran contactos entre ARNr Sin embargo, los puentes que se crean entre subunidades no confieren al ribosoma 70S una estructura totalmente rigida. La naturaleza dinamica del proceso de traduccion implica que el ribosoma sea una estructura flexible con componentes moviles que posibiliten su funcion En un ribosoma 70S, las dos subunidades se enfrentan de tal manera que se crea un espacio de morfologia complejo.
EUCARIOTICO

En células eucariotas, los ribosomas se elaboran en el núcleo pero desempeñan su función de síntesis en el citosol. Están formados por ARN ribosómico (ARNr) y por proteínas. Estructuralmente, tienen dos subunidades. En las células, estas macromoléculas aparecen en diferentes estados de disociación. Cuando están completas, pueden estar aisladas o formando grupos (polisomas). Las proteínas sintetizadas por los ribosomas actúan principalmente en el citosol; también pueden aparecer asociados al retículo endoplasmático rugoso o a la membrana nuclear, y las proteínas que sintetizan son sobre todo para la exportación.
Tanto el ARNr como las subunidades de los ribosomas se suelen nombrar por su coeficiente de sedimentación en unidades Svedberg. En las células eucariotas, los ribosomas del citoplasma se denominan 80 S. En mitocondrias y plastos de eucariotas, así como en procariotas, son 70 S.
- Subunidad mayor: es 60 S. Tiene tres tipos de ARNr: 5 S, 28 S y 5,8 S y tiene 49 proteínas, todas ellas distintas a las de la subunidad menor.
- Subunidad menor: es 40 S. Tiene una sola molécula de ARNr 18 S y contiene 33 proteínas. Dependiendo de qué organismo eucariota sea, este ARNr 18 S puede sufrir alteraciones.

lunes, 14 de mayo de 2012
ESTRUCTURA RIBOSOMAL

Los ribosomas son complejo macromoleculares de proteínas y ácido ribonucleico (ARN) que se encuentran en el citoplasma, en las mitocondrias en retículo endoplasmatico y en los cloroplastos. Son un complejo molecular encargado de sintetizar proteínas a partir de la información genética que les llega del ADN transcrita en forma de ARN mensajero (ARNm). Sólo son visibles al microscopio electrónico, debido a su reducido tamaño (29 nm en células procariotas y 32 nm en eucariotas). Bajo el microscopio electrónico se observan como estructuras redondeadas, densas a los electrones. Bajo el microscopio óptico se observa que son los responsables de la basofilia que presentan algunas células. Están en todas las células (excepto en los espermatozoides). Los ribosomas no se definen como orgánulos, ya que no existen endomembranas en su estructura.
Tanto el ARNr como las subunidades de los ribosomas se suelen nombrar por su coeficiente de sedimentación en unidades Svedberg. En las células eucariotas, los ribosomas del citoplasma se denominan 80 S. En mitocondrias y plastos de eucariotas, así como en procariotas, son 70 S.
TRADUCCION
Por tanto, la cadena polipeptídica ensamblada ha sido: Alanina-Arginina-Glicina-Metionina-Prolina-Serina.


Traducción (1) de ARNm por un ribosoma (2) en una cadena polipeptídica (3). El ARNm comienza con un codón de iniciación (AUG) y finaliza con un codón de terminación (UAG).
El ribosoma lee el ARN mensajero y ensambla los aminoácidos suministrados por los ARN de transferencia a la proteína en crecimiento, proceso conocido como traducción o síntesis de proteínas.
Todas las proteínas están formadas por aminoácidos. Entre los seres vivos se han descubierto hasta ahora 20 aminoácidos. En el código genético, cada aminoácido está codificado por uno o varios codones. En total hay 64 codones que codifican 20 aminoácidos y 3 señales de parada de la traducción. Esto hace que el código sea redundante y que haya varios codones diferentes para un mismo aminoácido.
La traducción comienza, en general, con el codón AUG que codifica el aminoácido metionina. Al final de la secuencia se ubica un codón que indica el final de la proteína; es el codón de terminación. El código genético es universal porque cada codón codifica el mismo aminoácido para la mayoría de los organismos (no todos).
El ribosoma consta de dos partes, la subunidad mayor y una menor, estas salen del núcleo celular por separado. Las subunidades se mantienen unidas por cargas. Al disminuir experimentalmente la concentración de Mg+2, las subunidades tienden a separarse.
Por ejemplo, en el citoplasma de una célula eucariota, el proceso con la siguiente secuencia de ARN mensajero sería este:
- AUG le indica que tiene que empezar a ensamblar la proteína. Es un codón de iniciación. Ensambla una metionina.
- GCC es alanina. Toma una alanina y la une.
- AAC es asparagina, lo une con la alanina.
- GGC es glicina, lo ensambla a la arginina.
- AUG era el símbolo de iniciación, pero el proceso ya ha comenzado. Une una metionina con la glicina anterior.
- CCU es prolina. Ensambla la prolina a la metionina.
- ACU es treonina. Ensambla la serina con la prolina.
- UAG es terminación. Deja de ensamblar la proteína
Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona.
Nelson, David L.; Cox, Michael M. (2006). Lehninger. Principios de bioquímica. Omega. pp. 1038-1058
TIPOS DE ARN
El ácido ribonucleico (ARN o RNA), es un ácido nucléico formado por una cadena de ribonucleótidos. Está presente tanto en las células procariotas como en las eucariotas, y es el único material genético de ciertos virus (virus ARN). El ARN celular es lineal y de hebra sencilla, pero en el genoma de algunos virus es de doble hebra.
En los organismos celulares desempeña diversas funciones. Es la molécula que dirige las etapas intermedias de la síntesis proteica; el ADN no puede actuar solo, y se vale del ARN para transferir esta información vital durante la síntesis de proteínas (producción de las proteínas que necesita la célula para sus actividades y su desarrollo). Varios tipos de ARN regulan la expresió génica, mientras que otros tienen actividad catalítica. El ARN es, pues, mucho más versátil que el ADN.
Tipos de ARN
El ARN mensajero (ARNm) es el tipo de ARN que lleva la información del ADN a los ribosomas, el lugar de la síntesis de proteínas. La secuencia de nucleótidos del ARNm determina la secuencia de aminoácidos de la proteína. Por ello, el ARNm es denominado ARN codificante.
No obstante, muchos ARN no codifican proteínas, y reciben el nombre de ARN no codificantes; se originan a partir de genes propios (genes ARN), o son los intrones rechazados durante el proceso de splicing. Son ARN no codificantes el ARN de transferencia (ARNt) y el ARN ribosómico (ARNr), que son elementos fundamentales en el proceso de traducción, y diversos tipos de ARN reguladores.
Ciertos ARN no codificantes, denominados ribozimas, son capaces de catalizar reacciones químicas como cortar y unir otras moléculas de ARN,o formar enlaces peptídicos entre aminoácidos en el ribosoma durante la síntesis de proteínas.
ARN implicados en la síntesis de proteínas
ARN con actividad catalítica
- Ribozimas. El ARN puede actuar como biocatalizador. Ciertos ARN se asocian a proteínas formando ribonucleoproteínas y se ha comprobado que es la subunidad de ARN la que lleva a cabo las reacciones catalíticas; estos ARN realizan las reacciones in vitro en ausencia de proteína. Se conocen cinco tipos de ribozimas; tres de ellos llevan a cabo reacciones de automodificación, como eliminación de intrones o autocorte, mientras que los otros (ribonucleasa P y ARN ribosómico) actúan sobre substratos distintos. Así, la ribonucleasa P corta un ARN precursor en moléculas de ARNt, mientras que el ARN ribosómico realiza el enlace peptídico durante la síntesis proteica ribosomal.
- Espliceosoma. Los intrones son separados del pre-ARNm durante el proceso conocido como splicing por los espliceosomas, que contienen numerosos ARN pequeños nucleares (ARNpn o snRNA). En otros casos, los propios intrones actúan como ribozimas y se separan a si mismos de los exones.
- ARN pequeño nucleolar. Los ARN pequeños nucleolares (ARNpno o snoRNA), hallados en el nucléolo y en los cuerpos de Cajal, dirigen la modificación de nucleótidos de otros ARN;el proceso consiste en transformar alguna de las cuatro bases nitrogenadas típicas (A, C, U, G) en otras. Los ARNpno se asocian con enzimas y los guían apareándose con secuencias específicas del ARN al que modificarán. Los ARNr y los ARNt contienen muchos nucleótidos modificados.
ARN mitocondrial
La mitocondrias tienen su propio aparato de síntesis proteica, que incluye ARNr (en los ribosomas), ARNt y ARNm. Los ARN mitocondriales (ARNmt o mtARN) representan el 4% del ARN celular total. Son transcritos por una ARN polimerasa mitocondrial específica.
- ARN mensajero. El ARN mensajero (ARNm o RNAm) lleva la información sobre la secuencia de aminoácidos de la proteína desde el ADN, lugar en que está inscrita, hasta el ribosoma, lugar en que se sintetizan las proteínas de la célula. Es, por tanto, una molécula intermediaria entre el ADN y la proteína y el apelativo de "mensajero" es del todo descriptivo. En eucariotas, el ARNm se sintetiza en el nucleoplasma del núcleo celular y de allí accede al citosol, donde se hallan los ribosomas, a través de los poros de la envoltura nuclear.
- ARN de transferencia. Los ARN de transferencia (ARNt o tRNA) son cortos polímeros de unos 80 nucleótidos que transfiere un aminoácido específico al polipéptido en crecimiento; se unen a lugares específicos del ribosoma durante la traducción. Tienen un sitio específico para la fijación del aminoácido (extremo 3') y un anticodón formado por un triplete de nucleótidos que se une al codón complementario del ARNm mediante puentes de hidrógeno.
- ARN ribosómico. El ARN ribosómico (ARNr o RNAr) se halla combinado con proteínas para formar los ribosomas, donde representa unas 2/3 partes de los mismos. En procariotas, la subunidad mayor del ribosoma contiene dos moléculas de ARNr y la subunidad menor, una. En los eucariotas, la subunidad mayor contiene tres moléculas de ARNr y la menor, una. En ambos casos, sobre el armazón constituido por los ARNr se asocian proteínas específicas. El ARNr es muy abundante y representa el 80% del ARN hallado en el citoplasma de las células eucariotas. Los ARN ribosómicos son el componente catalítico de los ribosomas; se encargan de crear los enlaces peptídicos entre los aminoácidos del polipéptido en formación durante la síntesis de proteínas; actúan, pues, como ribozimas.
ARN reguladores
Muchos tipos de ARN regulan la expresión génica gracias a que son complementarios de regiones específicas del ARNm o de genes del ADN. .
- ARN de interferencia. Los ARN interferentes (ARNi o iRNA) son moléculas de ARN que suprimen la expresión de genes específicos mediante mecanismos conocidos globalmente como ribointerferencia o interferencia por ARN. Los ARN interferentes son moléculas pequeñas (de 20 a 25 nucléotidos) que se generan por fragmentación de precursores más largos. Se pueden clasificar en tres grandes grupos:
- Micro ARN. Los micro ARN (miARN o RNAmi) son cadenas cortas de 21 ó 22 nucleótidos hallados en células eucariotas que se generan a partir de precursores específicos codificados en el genoma. Al transcribirse, se pliegan en horquillas intramoleculares y luego se unen a enzimas formando un complejo efector que puede bloquear la traducción del ARNm o acelerar su degradación comenzando por la eliminación enzimática de la cola poli A.
- ARN interferente pequeño. Los ARN interferentes pequeño (ARNip o siARN), formados por 20-25 nucleótidos, se producen con frecuencia por rotura de ARN virales, pero pueden ser también de origen endógeno. Tras la transcripción se ensambla en un complejo proteico denominado RISC (RNA-induced silencing complex) que identifica el ARNm complementario que es cortado en dos mitades que son degradadas por la maquinaria celular, bloquean así la expresión del gen.
- ARN asociados a Piwi. Los ARN asociados a Piwi son cadenas de 29-30 nucleótidos, propias de animales; se generan a partir de precursores largos monocatenarios, en un proceso que es independiente de Drosha y Dicer. Estos ARN pequeños se asocian con una subfamilia de las proteínas "Argonauta" denominada proteínas Piwi. Son activos las células de la línea germinal; se cree que son un sistema defensivo contra los transposones y que juegan algún papel en la gametogénesis.
- ARN antisentido. Un ARN antisentido es la hebra complementaria (no codificadora) de un hebra ARNm (codificadora). La mayoría inhiben genes, pero unos pocos activan la transcripción.El ARN antisentido se aparea con su ARNm complementario formando una molécula de doble hebra que no puede traducirse y es degradada enzimáticamente. La introducción de un transgen codificante para un ARNm antisentido es una técnica usada para bloquear la expresión de un gen de interés. Un mARN antisentido marcado radioactivamente puede usarse para mostrar el nivel de transcripción de genes en varios tipos de células. Algunos tipos estructurales antisentidos son experimentales, ya que se usan como terapia antisentido.
- ARN largo no codificante. Muchos ARN largos no codificantes (ARNnc largo o long ncARN) regulan la expresión génica en eucariotas; uno de ellos es el Xist que recubre uno de los dos cromosomas X en las hembras de los mamíferos inactivándolo (corpúsculo de Barr).
- Riboswitch. Un riboswitch es una parte del ARNm (ácido ribonucleico mensajero) al cual pueden unirse pequeñas moléculas que afectan la actividad del gen. Por tanto, un ARNm que contenga un riboswitch está directamente implicado en la regulación de su propia actividad que depende de la presencia o ausencia de la molécula señalizadora. Tales riboswitchs se hallan en la región no traducida 5' (5'-UTR), situada antes del codón de inicio (AUG), y/o en la región no traducida 3' (3'-UTR), también llamada secuancia de arrastre,situada entre el codón de terminación (UAG, UAA o UGA) y la cola poli A.
Suscribirse a:
Comentarios (Atom)